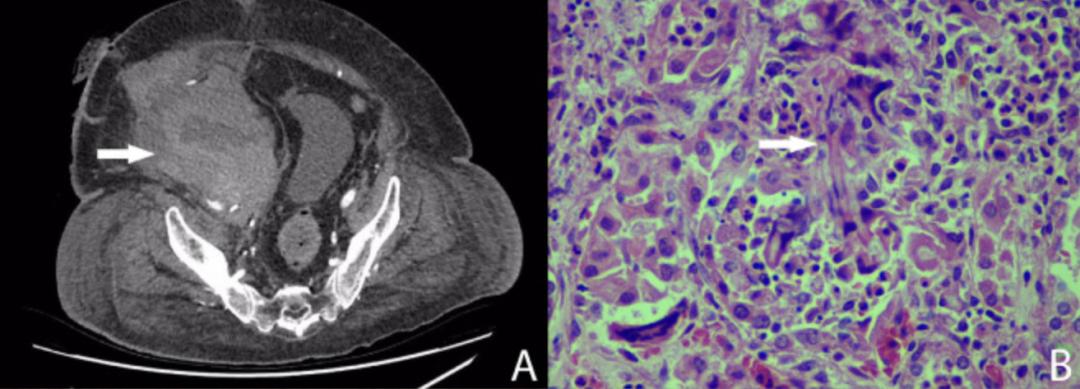
目前,侵袭性肺曲霉病(IPA)的发病率逐步增加。虽然已经有了诊断标准,但是,具体判断某个病人究竟是不是侵袭性肺曲霉病,始终是纠结内科医生或呼吸科医生的大问题——如果这个疾病不及时治疗,死亡率很高;过度治疗或者错误治疗,花费和代价也很大。因此,早期明确诊断,实现精准治疗非常重要,这也是我们一直努力的方向和目标。

我们先来看看江苏省呼吸分会感染学组肺真菌病临床研究数据(截止2018年底)
我们江苏省呼吸分会感染学组的肺真菌病临床研究,用两年左右的时间共收集了708例肺真菌病病例,这些病例都是能够达到临床诊断甚至是确诊的病例。从数据来看,曲霉例数最多,达到524例(数据主要来自呼吸与危重症医学科病房代表的是呼吸医生所诊治的病人状况),其次是隐球菌。
再来看看各种类型肺曲霉病例数
曲霉导致肺部疾病的表现类型多种多样,包括侵袭性肺曲霉病(IPA)、慢性肺曲霉病(CPA)或变应性支气管肺曲霉菌病(ABPA)。其临床诊疗大相径庭。从省流调数据来看,IPA例数最多(321例),其次是CPA(167例),ABPA例数最少(36例)。但是国外的很多研究数据显示,CPA病人的数量比IPA多,ABPA病人又比CPA多,那为什么我们的数据恰巧相反?我认为可能由于我们现在更加重视IPA,因为这个疾病的病死率高,病情发展得快,非常凶险。对于CPA和ABPA来说,临床上总体来说临床关注度不够,因此还有待后期加大力度开展临床研究和推广、普及工作。
重点分析IPA临床微生物学诊断
我们想达到高级别的、可靠的诊断,离不开临床微生物学证据。如果仅仅根据病人的临床表现和影像学表现,而没有微生物学的证据,诊断IPA的可靠性就会大打折扣,远远达不到精准诊疗。
临床微生物的诊断方法有哪些?
传统诊断方法包括真菌直接镜检、真菌培养和组织病理学检查。这几种方法在临床应用时间长,应用范围广,目前几乎每个教学医院都在开展,后面会有这几种方法在临床应用效果的数据分析。IPA病情发展迅速,传统诊断方法存在报告时间长,敏感性低等缺陷。
近几年新的快速诊断方法对临床的帮助很大,包括抗原检测(G、GM、LFD)(血、BALF、尿),抗体检测(IgG、IgM)(血),PCR、二代测序等基因检测(BALF、组织),新型分子标志物(PTX3等)(血、BALF)。
1、真菌培养

首先谈谈真菌培养,培养始终是诊断各种感染疾病的基石,对于大部分情况而言,培养是一个金标准。发表在Am J Respir Crit Care Med 2012年的指南要求,对于重症ICU病人,诊断为肺曲霉病必须要有培养结果。距离发表已经过去7年,现在再来看这个标准,存在一定的局限性。因为如果必须要有培养的结果,那很多病人就会漏诊。但是从这点至少可以看出培养的重要性。
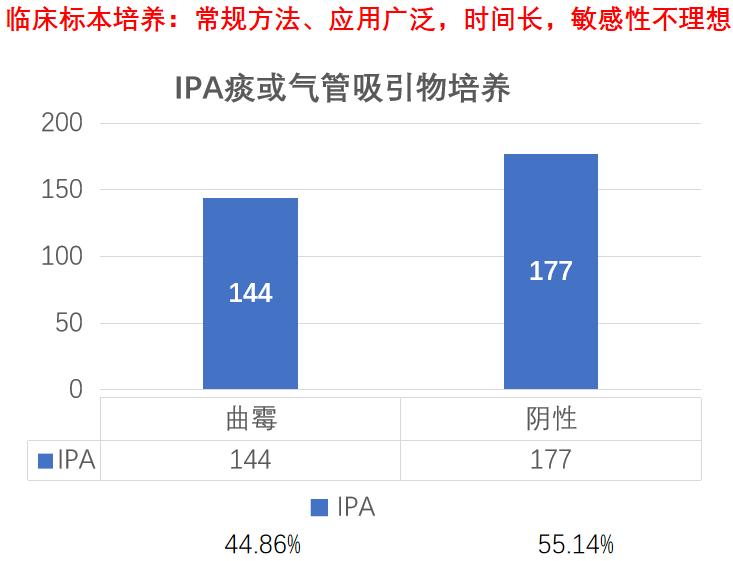
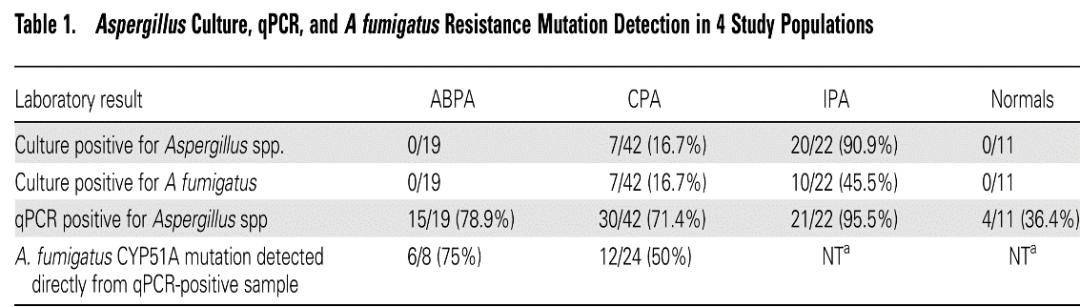
江苏省流调的临床数据显示,IPA总病例数321,培养送检率100%,144例培养结果为阳性,阳性率为44.86%。由此可见,临床标本培养是应用最广泛的方法,但它的敏感性不理想,尤其是在微生物条件不好的实验室,敏感性就更低,另外出报告的时间较长。
2、直接镜检

对于很多临床标本来说,直接镜检是一项重要的方法。「英国医学真菌学学会在诊断严重真菌病的最佳实践建议」中就推荐了镜检,与培养相比,可快速获取结果(2~4小时),新的染色方法有助于快速识别曲霉菌丝。
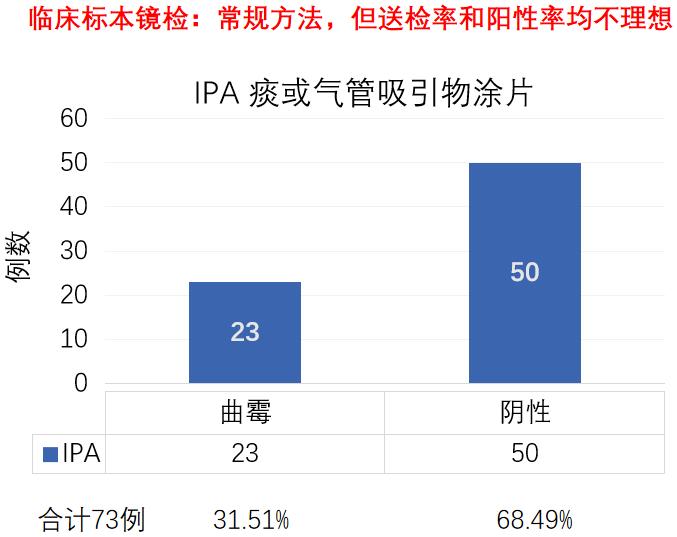
但是,镜检在临床中的应用并不理想,以江苏省的数据为例,IPA总病例数321,镜检送检率只有22%。这可能是临床医生对镜检重视不够,也可能很多实验室没有很好的开展这项工作。
3、组织标本病理学检查
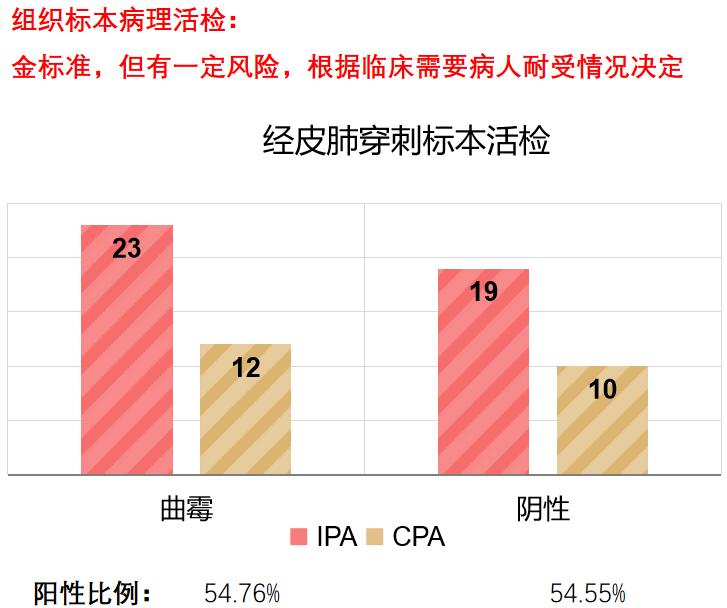
病人肺部有实变影、团块影,如果要与肺结核、肿瘤等相鉴别诊断,病人的一般情况允许时,做组织标本病理活检是金标准,拿到这个结果才能确诊。组织标本取材可以做TBLB,也可以做经皮肺穿刺标本活检。从经皮肺穿刺标本活检的数据来看,阳性率54.76%,接受活检的病例中大概有一半左右的病例能够确诊。
如果病变靠近中央,可以做TBLB活检;如果病变贴近胸壁,可以选择经皮肺穿刺标本活检。做这些有创检查时可能会出现咯血、气胸、感染播散至胸腔等。
组织病理的诊断率在20%~80%,与病理科医师的临床经验密切相关

病理活检诊断阳性率,还会受到临床病理科医生的经验所影响。病理结果为阴性不能排除曲霉感染,不是取到病理就一定能明确诊断。对于肺曲霉病在内的各种良性疾病来说,它的敏感性还有待提高。
通过传统诊断方法无法确诊的病人要如何诊断?

以上数据显示,仅仅使用传统诊断方法不能满足临床需要。通过传统方法无法确诊的病人要如何诊断?2017年《柳叶刀感染性疾病》杂志报道了侵袭性曲霉病在非粒缺危重病人,通过GM实验、LFD、PCR等检查帮助诊断。
1、GM检测:应用越来越广泛,BALF标本敏感性更高

对于粒细胞缺乏或严重免疫缺陷的病人,血GM实验是一个行之有效的方法。但是在呼吸学科病房,绝大多数时非粒缺的病人,免疫缺陷不是很严重,血GM实验的敏感性就大大降低。
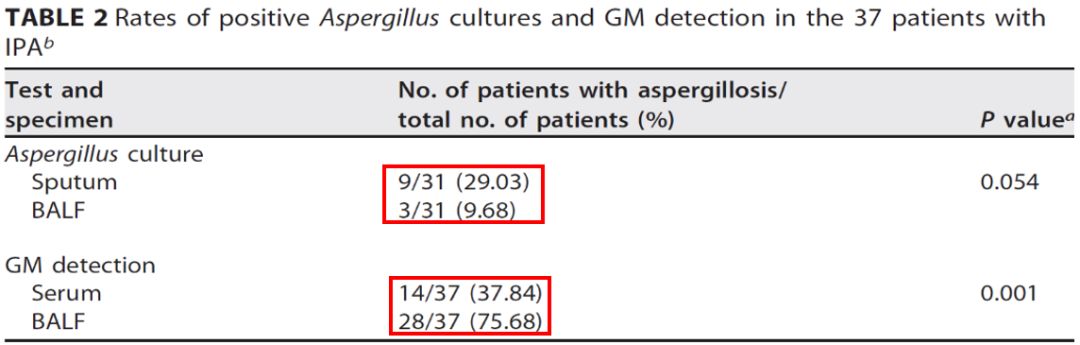
所以在这种情况下,我们可以给这些病人做肺泡灌洗液GM。我们有关BALF 的GM检测临床价值的研究发表在2017年JCM杂志。我们的研究中,IPA患者血GM阳性率只有37.8%,而同样的这组病人,BALF GM阳性率能达到75.68%。因此说BALF GM大大提高了肺曲霉病的临床检出率。针对肺曲霉病的诊断而言,不管是粒缺还是非粒缺的病人,最好做BALF GM。
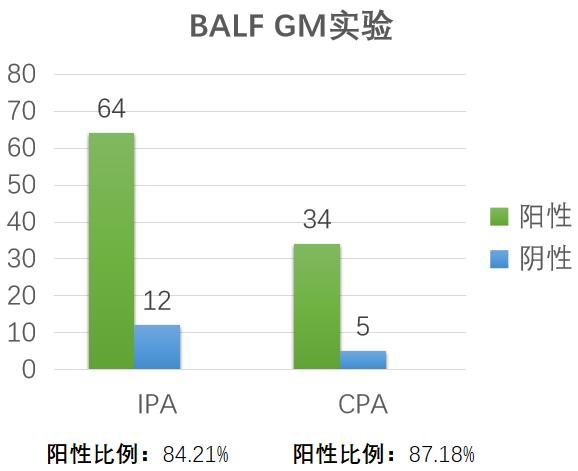
我们在江苏省流调中的数据也是这样,BALF GM阳性率达到80%以上。
2、GM LFD test:床旁快速诊断方法
GM实验现在主要用ELISA方法做,临床实验室一星期做1~2次,如果想尽快知道结果,可以采用金标法——LFD(免疫层析侧流装置)。LFD是一个床旁快速诊断方法,目前在临床的应用越来越广泛。检测曲霉抗原的LFD方法已经被研发出来,但前期不同的临床研究显示,敏感性数据变异较大,敏感性从40%到82%,还需要更多的临床研究来验证。

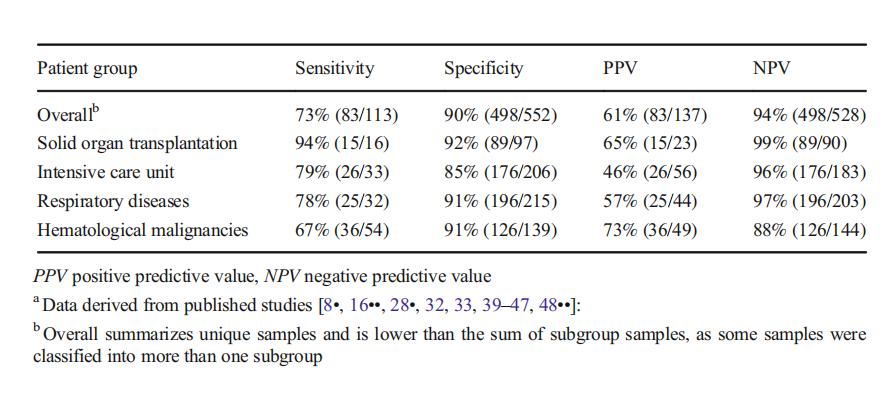
BALF标本LFD比血标本的敏感性要好,敏感性最低为67%,特异性更好。
3、PCR法诊断肺曲霉病:敏感性高,有一定的假阳性,阴性预测值高
PCR技术在很多病原学诊断中发挥着非常重要的作用,比如社区获得性肺炎中诊断支原体、军团菌,PCR都是金标准。对于肺曲霉病而言,PCR技术的敏感性高,但是有一定的假阳性,阴性预测值高。所以要想把这方面做好,实验室标准化可能是一个难点。
肺泡灌洗液PCR检测:值得期待

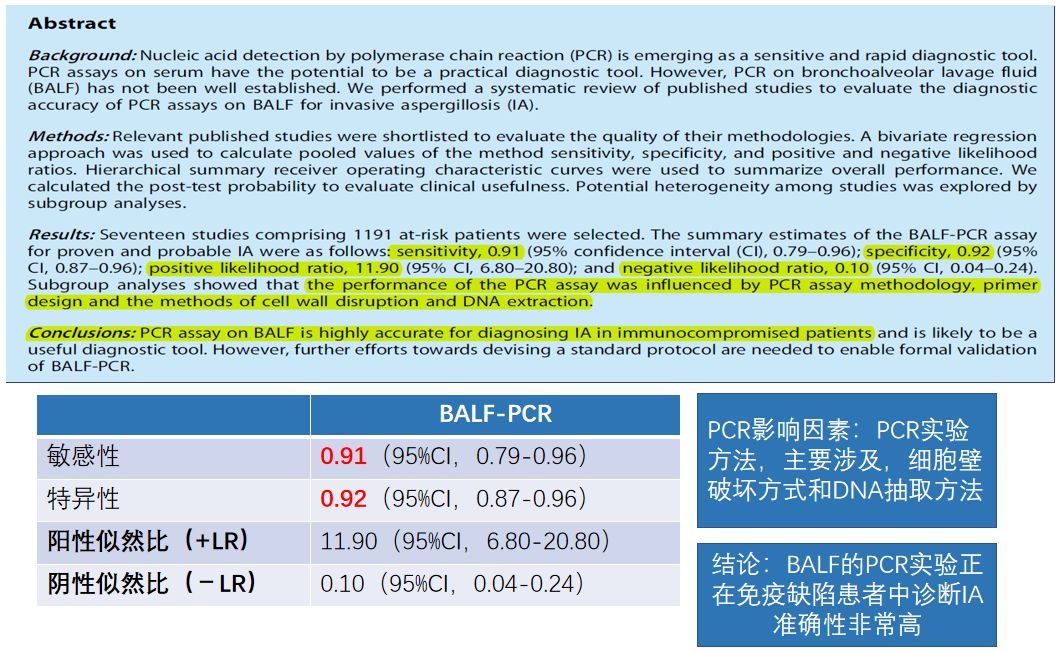
我们做过有关肺泡灌洗液PCR检测的Meta分析,发现BALF的PCR诊断IA,它的敏感性、特异性总体来说还是很高的。PCR检测在临床推广应用,还需要实现检测标准化。
4、二代测序诊断肺曲霉病临床病例

基因检测除了PCR方法以外,现在比较热门的是二代测序技术。在临床上,我们碰到病例,BALF GM为阴性,但是NGS做出来是阳性的,于是给病人进行抗曲霉治疗,有效,这篇文章已被美国转化研究杂志接收。总体来说,NGS在诊断IPA中的价值,还有待进一步临床研究。
5、血清曲霉特异性抗体检测:亚急性肺曲霉病或慢性肺曲霉病
很多病人做BALF可能无法耐受,这种情况下,我们还可以做一些无创检测,比如抽血查曲霉特异性抗体。血清曲霉IgG抗体产生时间平均11天,粒缺合并急性侵袭性曲霉感染病程短,免疫反应低,敏感性仅为25~30%左右。近来发现,COPD等非严重免疫缺陷患者合并烟曲霉感染时,病程往往较长,有足够时间产生针对曲霉的免疫反应,因此IgG抗体的检测更具有诊断价值。
现在主要研究IgG抗体,它诊断慢性肺曲霉病的表现非常棒:

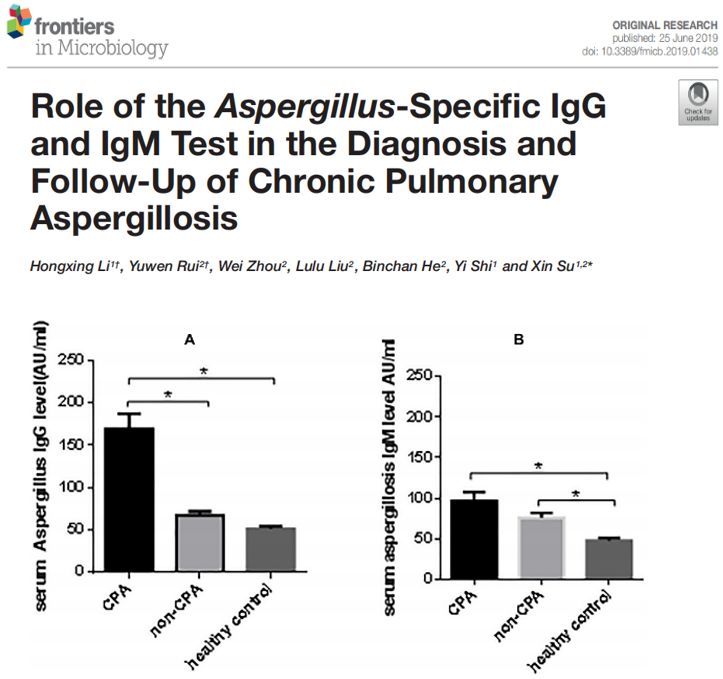
我们前期做了IgG和IgM诊断肺曲霉病的临床研究。前期主要分析了抗体在CPA中的应用价值。研究成果发表在Frontiers in Microbiolgy,IPA病人后期数据还在总结中。通过分析发现,IgG结果更优异。
不同血清学检测方法对IA、CPA及ABPA的敏感性
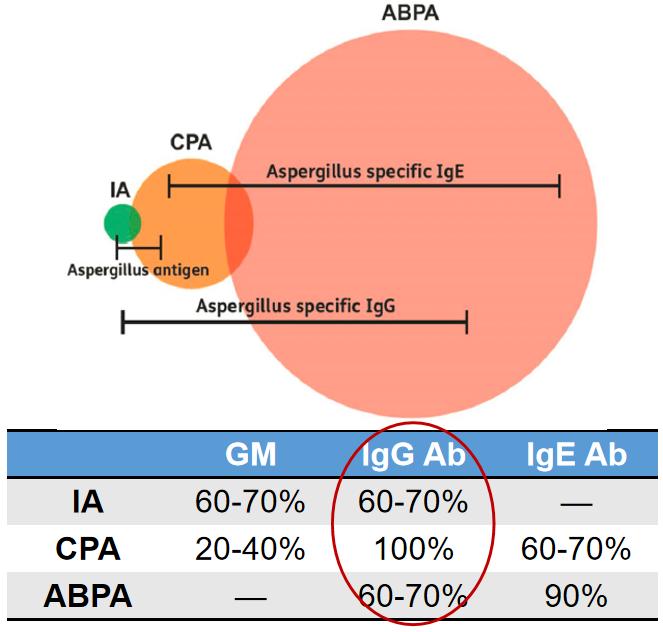
这个图片非常直观,对于CPA来说,IgG是最好的,并且也可以检测一些病程相对较长的IPA病人,以及ABPA病人。
新型生物标志物-PTX3
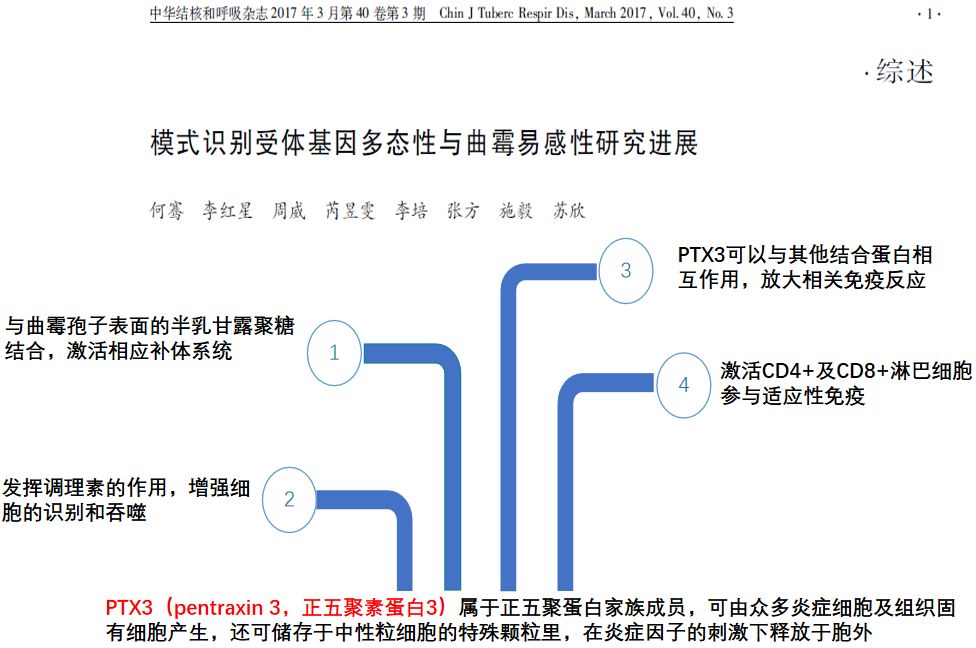
正五聚素蛋白3(PTX3)是我们前期关注的一种炎症相关蛋白,在感染等炎症反应中,释放到细胞外,参与免疫反应。它本身也是一种曲霉模式识别受体,在机体感染曲霉后,炎症部位PTX3水平增多聚集,识别结合曲霉表面抗原,促进巨噬细胞吞噬曲霉。
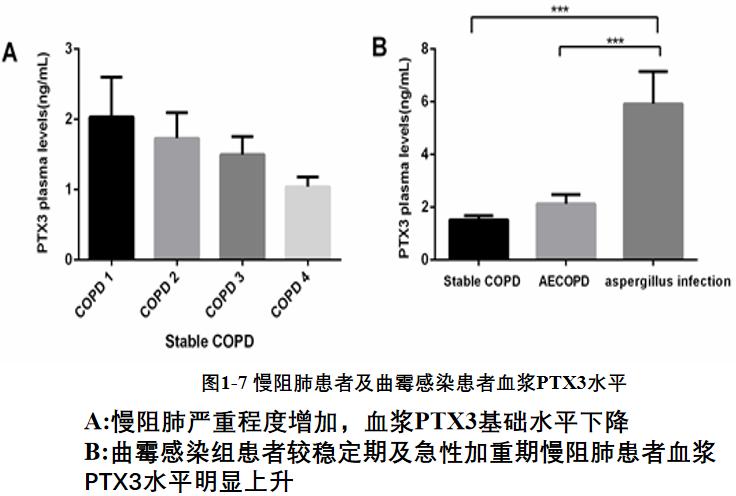
我们分析了慢阻肺患者及曲霉感染患者血浆PTX3水平。结果显示,在稳定期慢阻肺患者中,随着肺功能的下降,患者血浆PTX3水平有下降趋势。图B显示合并曲霉感染患者血浆PTX3水平较稳定期组及急性加重组都明显升高。
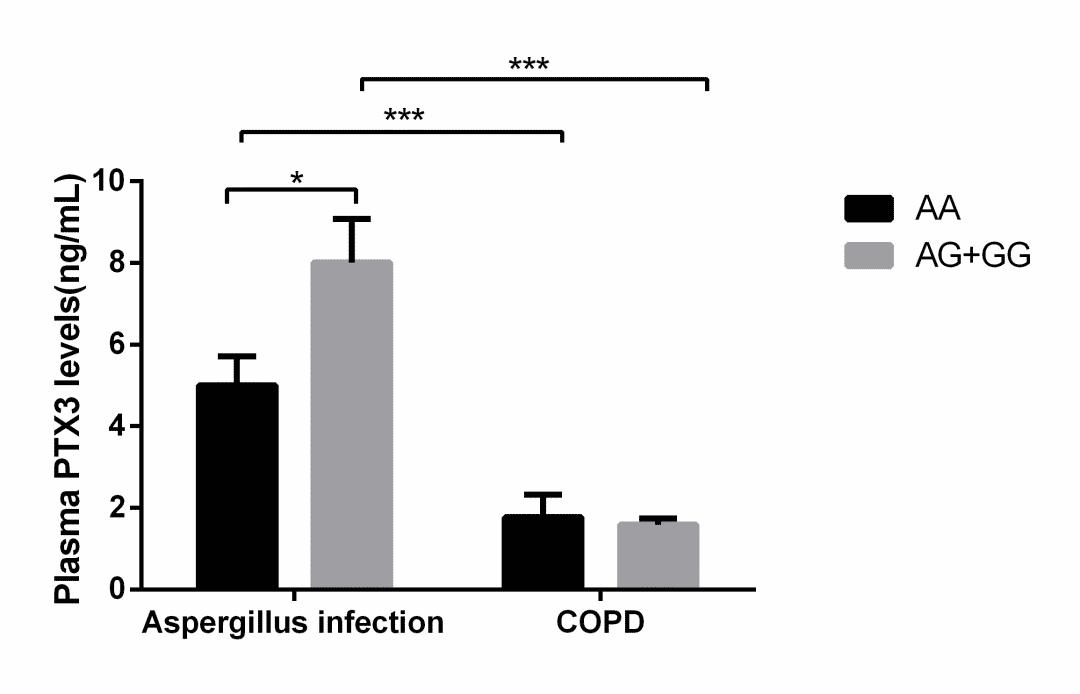
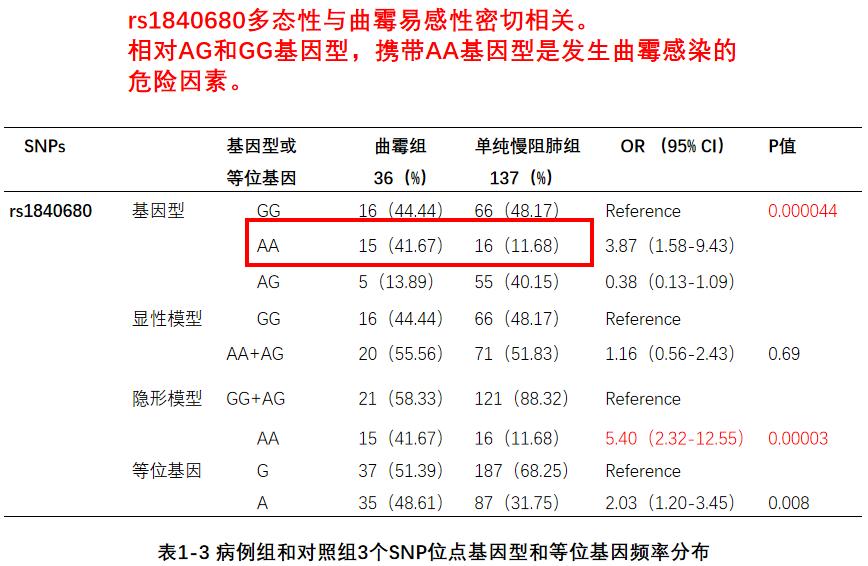
进一步研究发现,PTX3的DNA序列中,与其转录因子结合部位的一个SNP位点rs1840680多态性与曲霉易感性密切相关。我们分析了这个位点不同基因型患者的血浆PTX3水平。在单纯慢阻肺组中,AA基因型与AG/GG基因型相比,血浆PTX3水平之间无明显差异。而在合并曲霉感染组,AA基因型患者血浆PTX3水平较AG或GG基因型患者明显下降。带来的后果是AA基因型患者易感曲霉。
慢阻肺是罹患肺曲霉病的高危因素,但我国慢阻肺患者近1亿,如果把他们都当成IPA的高危人群,肯定不行。除了肺功能、急性加重情况、激素和抗菌药物使用等指标外,我们还可以筛查患者PTX3的rs1840680位点的基因型。如果是AA基因型的患者,意味着增加了罹患曲霉的风险,为临床医生做出判断增加了一个评价指标。

我们这一成果发表在2018年CID杂志上。这个研究同时给我们提示,PTX3在曲霉患者外周血中明显升高。能否将其作为诊断曲霉病的生物标志物?我们做了曲霉感染患者血浆和肺泡灌洗液PTX3检测,发现和对照组相比,曲霉患者的血浆PTX3水平均显著高于其他分组。
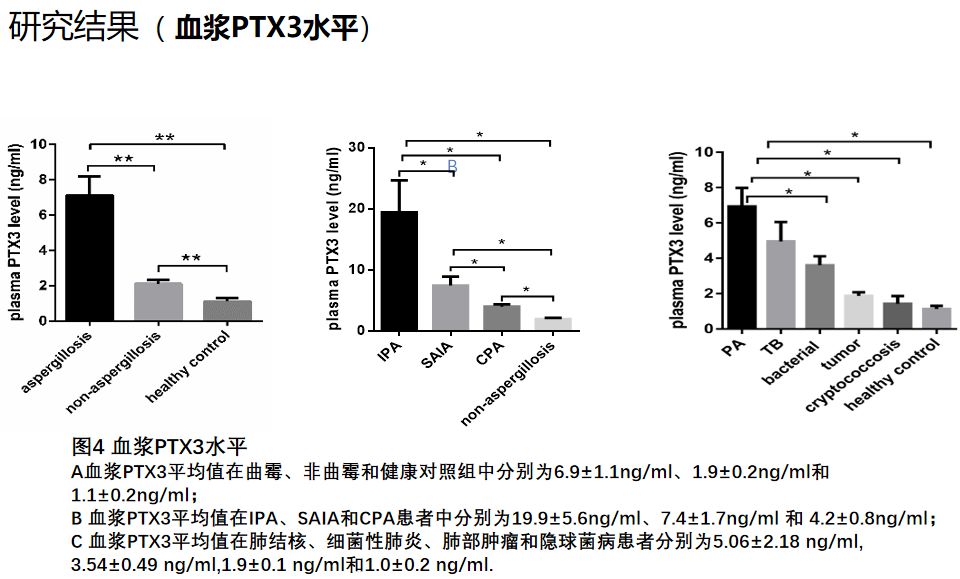
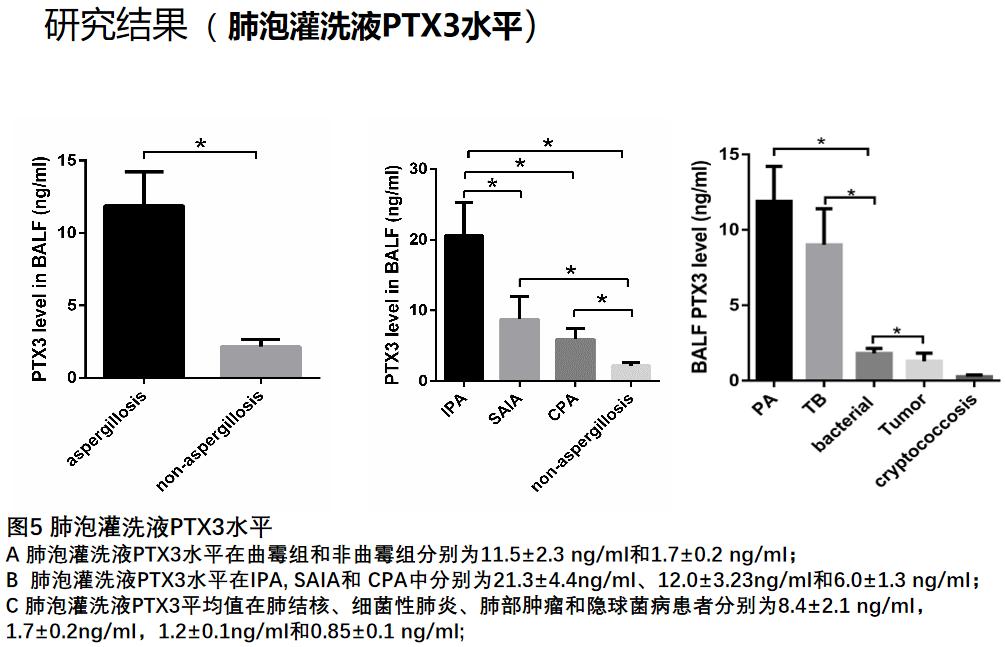
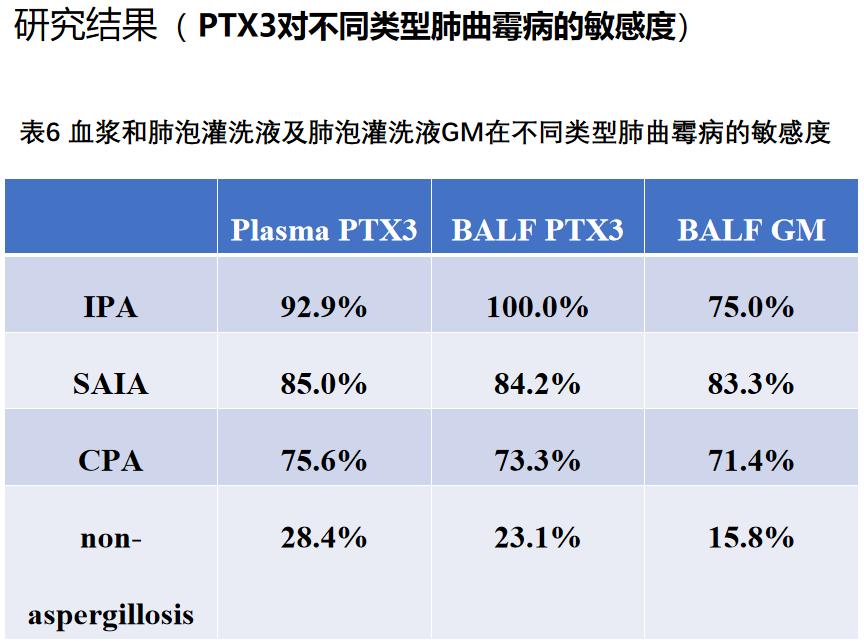
不管是血浆还是肺泡灌洗液PTX3,诊断IPA的敏感性最高,SAIA其次,CPA最低,且等于或优于肺泡灌洗液GM检测价值。这项研究发表在2019年的CMI杂志上。当然,这个只是初步探索性的研究结果,还要更大样本的、前瞻性多中心研究来证实。

检测尿标本能否判断肺曲霉病?
对于长时间免疫缺陷,或严重慢阻肺、糖尿病等高危因素持续存在的人群,在一定时间内抽血次数过多、反复做肺泡灌洗都不太现实,病人也不愿接受。能否有更加无创的方法检测病人是否患有肺曲霉病,我们能否检测尿标本?

近几年一直有团队在做利用尿标本诊断曲霉感染的研究。主要是检测尿液样本的曲霉抗原。这个检测具有诸多优势,包括无创性和易于方法收集样本检测,甚至有很大的潜力实现患者家庭测试。最近的研究表明,尿液样本中GM检测可能有潜在诊断价值,而尿液G实验检测的结果不那么令人信服。研究发现,尿GM抗原含量低,GM诊断阈值取0.1时,尿液中GM敏感性71%,特异性88%。这一研究结果,也需要进一步证实。


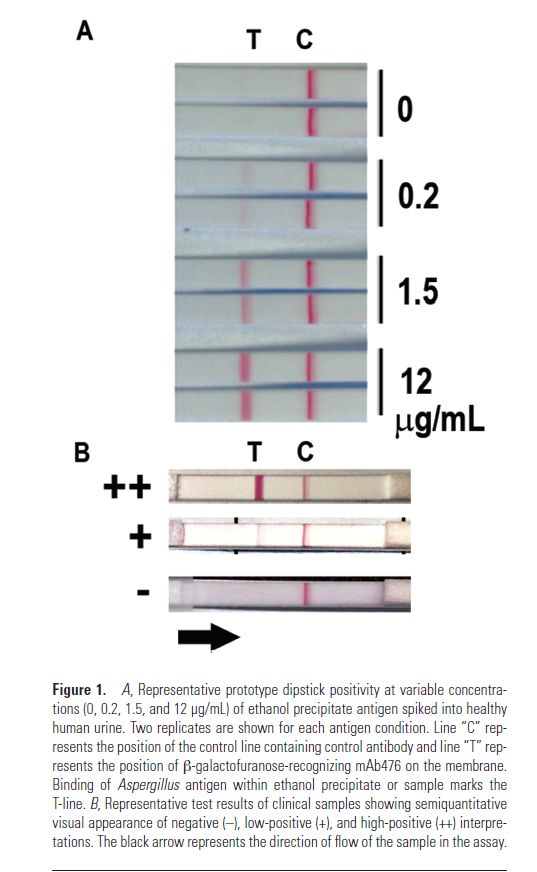
2018年CID杂志上发表的一个研究,使用一种新的曲霉抗原,叫做呋喃半乳糖。研究者利用这个抗原做出一个抗体,叫做mAb476。利用这个抗体结合到LFD装置诊断曲霉病。检测结果分为强阳性、弱阳性、阴性来判断。最后发现敏感性和特异性能达到80%,这是相当不错的结果。这个结果也鼓舞临床医师进一步研究尿抗原诊断这一个有潜力的未来发展方向。
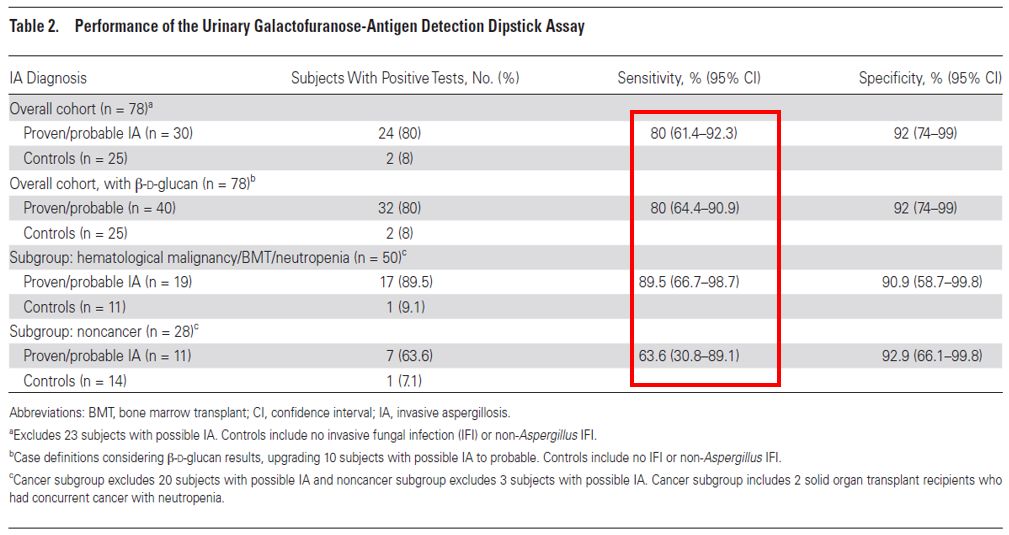
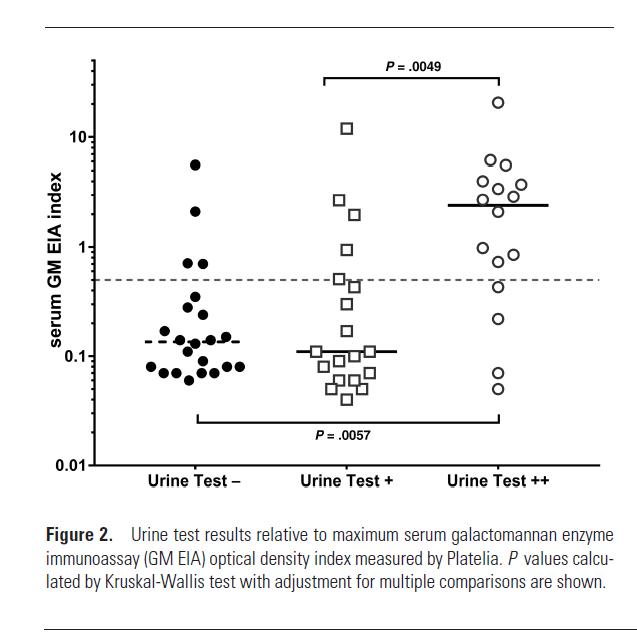
2019年「医学真菌病学」杂志发表的一篇综述,列举了现在临床使用的曲霉病诊断的微生物学方法:


直接镜检、培养和组织病理学检查,这都是传统方法,也是各个医院已经常规开展的检查。GM或其他的生物标志物、LFD、PCR及其他的基因检测手段,是作者推荐的可以在临床应用的新方法。

作者横向比较了这些方法,提出在不同类型的肺曲霉病人身上,有不同的适用范围。培养、镜检、GM、基因检测,包括临床影像学,对IPA病人诊断很重要;对于CPA来说,除了培养、镜检、基因检测和影像学以外,抗体检测非常重要,而不推荐血GM检测;对于ABPA来说,IgE和IgG抗体检测尤为重要,其次是影像学和培养,其他方法似乎都不是很理想。所以,针对不同人群,需要我们合理组合应用现有方法进行诊断。
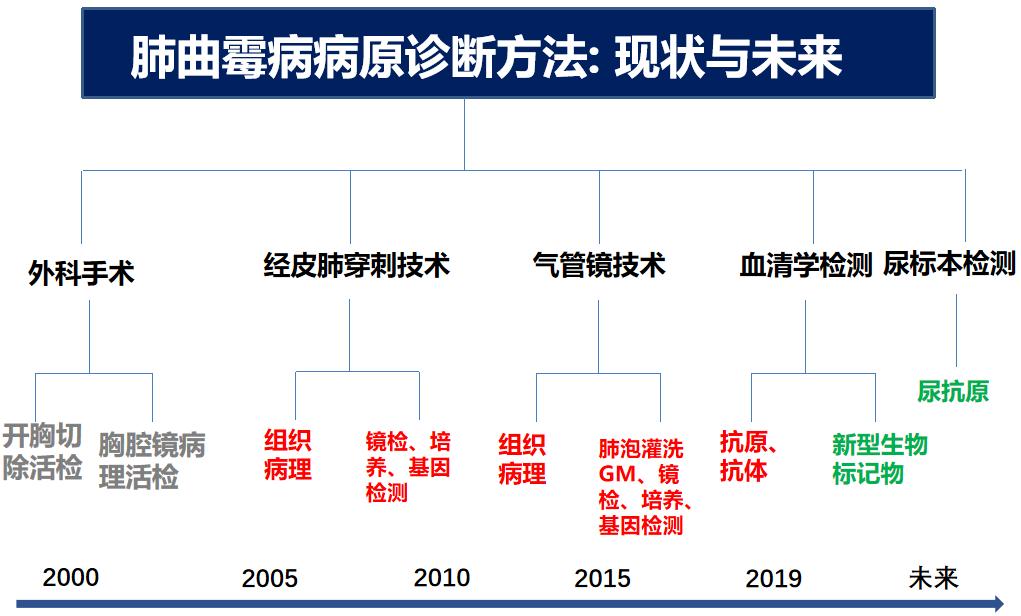
我们再从获取标本的方法来看,近20年走过了一个快速发展的里程。在本世纪初,我们想诊断肺曲霉病,往往要开胸活检。后来,通过经皮肺穿刺技术、气管镜技术、血清学检测等微创方法获取标本(红色部分是现在临床常常使用的方法),未来也许通过无创方法获得尿标本,通过新型生物标志物来帮助我们诊断肺曲霉病。这就是临床科研和技术的发展带来的临床诊断方法的进步。任何一个方法都有优点和缺点。在临床应用中,我们临床医生如何进行合理的组合很重要。如果仅仅依靠一个方法,可能犯错的概率还是很多。但是把这些方法合理组合起来应用,会使我们的诊断更加准确可靠,真正往感染的精准方向去发展。
参考文献
[1]Am J Respir Crit Care Med. 2012;186:56-64
[2]Schelenz S, et al. The Lancet Infectious Diseases, 2015, 15(4):461–474.
[3]Guarner J, Brandt M E. Clinical microbiology reviews, 2011, 24(2):247–280.
[4]Pfeiffer CD. Clin Infect Dis 2006;42(10):1417–727
[5]Shin B et al. J Infect. 2014. 68(5): 494-9.
[6]Wei Zhou, et al. Journal of Clinical Microbiology. 2017 Apr
[7]Tborac Dis 2019;11(2):465-476
[8]White PL, Parr C, Thornton C, Barnes RA.. J Clin Microbiol. 2013;51(5):1510–6.
[9]Held J, Schmidt T, Thornton CR, Kotter E, Bertz H.Infection. 2013;41(6):1163–9.
[10]Thornton CR. Clin Vaccine Immunol. 2008;15(7):1095–105
[11]Metan G, Keklik M, Dinc G, Pala C, Yildirim A, Saraymen B, et al. Indian J Hematol Blood Transfus. 2017;33(1):87–92
[12]Prattes J, Lackner M, Eigl S, Reischies F, Raggam RB, Koidl C,et al. Mycoses. 2015a;58(8):461–9.
[13]Prattes J, Koidl C, Eigl S, Krause R, Hoenigl .J Inf Secur. 2015b;70(5):541–3.
[14]Prattes J, Orasch T, Eigl S, Heldt S, Duettmann W, Faserl K, et al.Forum Infect Dis. 2016c;3(Suppl 1):1558.
[15]Heldt S, Eigl S, Prattes J, Flick H, Rabensteiner J, Neumeister P,et al. ECCMID 2017:Poster #P0989.
[16]Miceli MH, Goggins MI, Chander P, Sekaran AK, Kizy AE,Samuel L, et al.. Mycoses.2015;58(6):368–74.
[17]Clinical Infectious Diseases 2011;52(9):1123–1129
[18]Page I D, Richardson M D, Denning D W. Journal of Infection, 2016, 72(2): 240-249.
[19]BMC Infectious Diseases,修回
[20]Page I D, Richardson M, Denning D W. Medical mycology, 2015,53 (5): 417-439.
[21]何骞,等. 中华结核和呼吸杂志。2017,40(3)
[22]Hongxing Li,et al,Clinical Microbiology & Infection,2019
[23]Reischies FM, et al.. J Clin Microbiol. 2016c;54(3):771–4.
[24]Dufresne SF,et a. PLoS One. 2012;7(8):e42736.
[25]Duettmann W. Mycoses. 2016;59(6):374–8.
[26]Fisher BT,et al. J Pediatric Infect DisSoc.2012;1(2):103–11
[27]Duettmann W, et al. Med Mycol. 2014;52(6):647–52.
[28]Detection of urinary excreted fungal galactomannan-like antigens for diagnosis of invasive aspergillosis. PLoS One 2012;7:e42736.
[29]Medical Mycology, 2019, Vol. 57, No. S2
专家介绍

苏欣
主任医师,教授,博导;东部战区总医院呼吸与危重症医学科副主任;中华医学会呼吸分会青年委员;中华医学会呼吸分会感染学组委员;中国医师协会呼吸分会青委;江苏省医学会呼吸分会委员兼青委副主委。
版权声明:CosMeDna所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系删除!
本文链接://www.cosmedna.com/article/764523577.html