Functional Identification of Corynespora cassiicola-Responsive miRNAs and Their Targets in Cucumber
//p1-tt.byteimg.com/origin/pgc-image/828a67f17e2d468fbf9e728411c7002e.jpg" style="width: 650px;">
摘要:
【研究目标的重要性】靶叶斑病(TLS)是由棒状杆菌(C. cassiicola)引起的,是黄瓜(Cucumis sativus L.)中最重要的疾病之一。【研究基础】我们以前的研究通过高通量测序鉴定了黄瓜中的C. cassiicola响应miRNA,包括两个已知的miRNA和两个新的miRNA。这些miRNA的靶基因与次级代谢有关。【研究内容1】在这项研究中,我们通过GUS的组织化学染色和荧光定量分析验证了这些miRNA与靶基因之间的相互作用。【研究内容2】我们在黄瓜子叶中瞬时表达了候选miRNA和靶基因,以研究对C. cassiicola的抗性。【研究结果1】黄瓜中miR164d,miR396b,Noveal-miR1和Novel-miR7的瞬时表达导致对C. cassiicola的抗性降低,而NAC(被miR164d抑制),APE(被miR396b抑制),4CL(被Novel- miR1)和PAL(被Novel-miR7抑制)导致对C. cassiicola的抗性增强。【研究结果2】此外,4CL和PAL的过表达下调了木质素的合成,【研究结果3】Novel-miR1和Novel-miR7的过表达也下调了木质素的合成,这表明Novel-miR1和Novel-miR7对4CL和PAL的调节可能影响木质素含量。【研究结果4】成功构建了烟草摇铃病毒(TRV)诱导的短串联靶模拟物(STTM)-miRNA沉默载体,并成功沉默了靶miRNA。【研究结论】疾病抗性和木质素含量的鉴定表明,沉默候选miRNAs可以提高黄瓜对C. cassiicola的抗性。Introduction
黄瓜(Cucumis sativus L.)目标叶片斑点(TLS)是由Corynespora cassiicola(C。cassiicola)引起的,Corynespora cassiicola是专性的卵菌病原体(Teramoto等,2011; Li等,2012)。 TLS影响全世界的黄瓜,包括中国的黄瓜(Li等,2012; Yang等,2012),美国的(Ishii等,2007),日本的黄瓜(Miyamoto等,2010)。和韩国(Kwon et al。,2003)。 TLS是一种叶面疾病,可发生在黄瓜整个生长期,但在生长期的中后期要比其他阶段更为严重(Wen等人,2015)。 C. cassiicola分生孢子的大小和结构以及菌落的颜色都有很大的差异。这些变异不仅反映在同一菌株的不同菌落中,而且反映在不同地理起源和不同寄主的菌株中(Nghia等,2008; Qi等,2011)。因此,重要的是研究黄瓜对C. cassiicola的抗性分子机制,寻找新的抗性基因资源。
植物微RNA(miRNA)是一类由内源基因编码的小型非编码单链RNA,主要在转录后水平上参与基因表达和调控(Waterhouse and Hellens,2015)。在植物中,miRNA可以通过与靶基因相互作用而发挥功能,主要是通过降解和抑制靶mRNA来实现的(Slack等,2000; Khraiwesh等,2012)。植物在生长过程中经常遭受各种环境压力。这些胁迫会导致各种物质的积累,并诱导植物相关基因的表达和代谢途径,从而增强植物的抗性。最近,已发现许多编码与压力相关的蛋白质的基因,并且miRNA已显示在这些基因的表达中具有重要的调控作用(Sanan-Mishra等,2009; Baxter等,2014; Liu等。 ,2015; Zhang and Wang,2015)。病原体感染后可以诱导许多植物miRNA,这些miRNA可以通过与靶标相互作用而参与植物抗病性(Thiebaut等,2015)。 miR393是第一个报道的参与植物与病原体相互作用的miRNA(Navarro等,2006)。在拟南芥中,miR824,miR843,miR852,miR166,miR156和miR159可能对丁香假单胞菌有反应(Zhang等人,2011)。番茄中miR482b的过表达通过抑制NBS-LRR的表达降低了对疫霉菌的抗性,而沉默miR482b则增加了抗性(Jiang等,2018)。在黄瓜中,一些研究已经鉴定出许多与生长和胁迫反应相关的miRNA(Martínez等人,2011; Mao等人,2012; Li等人,2014; Jin和Wu,2015; Burkhardt和Day,2016) ),但目前尚无与C. cassiicola耐药相关的miRNA的报道。
病原体感染后,植物将产生次生代谢产物来抵抗病原体入侵(Pateraki和Kanellis,2010; Pusztahelyi等,2015)。在植物中,有两种主要类型的次生代谢产物会影响抗病性。一种是植物固有的物质,例如木质素,call质和角蛋白。这些物质可以增强细胞壁并防止病原体破坏植物组织(Zhao和Dixon,2011)。另一类包括病原体诱导的生物碱,萜烯和酚。这些物质具有直接的杀菌作用(Agrawal和Weber,2015年)。木质素是细胞壁的重要组成部分,具有复杂的结构和诱导的特性。增加木质素含量可以增强植物细胞抵抗渗透和溶解并抑制病原细菌在植物中扩散的能力(Zhao和Dixon,2011; Li等,2015)。苯丙氨酸氨裂合酶(PAL)和4-香豆酸酯:CoA连接酶(4CL)是参与苯丙烷合成的两个关键基因。它们可以促进木质素的合成以增强植物的抗病性(Kim和Hwang,2014; Li等,2015)。
在我们之前的研究中,进行了高通量测序,以研究接种C.cassiicola的黄瓜中差异表达的miRNA,包括两个已知的miRNA(miR164d和miR396b)和两个新颖的miRNA(Novel-miR1和Novel-miR7)(Wang等)等(2018)。基于对靶基因功能的分析,我们认为这些miRNA在黄瓜和C. cassiicola之间的相互作用中起重要作用。为了进一步阐明黄瓜中的miRNA,有必要有效而准确地证明miRNA与靶基因的相互作用。在这项研究中,候选miRNA和靶基因在烟草中瞬时表达,并且通过GUS组织化学染色和荧光定量分析确定了miRNA与靶基因之间的相互作用。同时,候选miRNA和靶基因在黄瓜子叶中瞬时表达,以研究转基因黄瓜对C. cassiicola的抗性。通过miRNA的调控,分析了黄瓜对C. cassiicola的抗性机理,为进一步稳定的植物遗传转化和育种研究提供了理论参考。
由于miRNA的大小短和家族功能的冗余,传统的基因沉默方法不适用于miRNA研究。靶标模拟物(TMs)可以阻断miRNA对靶基因的抑制,从而抑制miRNA的调节功能(Franco-Zorrilla等,2007; Meng等,2012)。唐等。 (2012年)发现了一种新的miRNA沉默调节机制,即短串联靶模拟物(STTM),它具有较高的沉默效率,可广泛用于miRNA的功能研究。 STTM由两个TM和一个48 nt的连锁序列组成。在STTM两侧的TM的第10和11个核苷酸之间有3个核苷酸形成凸出,因此,结合位点可以捕获miRNA,而不会被它们切割。与TM相比,STTM对miRNA具有更好的抑制作用(Yan等,2012)。病毒诱导的基因沉默(VIGS)可以诱导植物内源基因沉默并改变植物表型以探索基因功能(Sha等人,2014)。烟草吵闹病毒(TRV)是一种RNA病毒,可以感染多种植物。基于TRV的载体具有轻度的感染症状和高的基因沉默效率(MacFarlane等,1999)。基于TRV的载体已被广泛用于VIGS中,以抑制多种植物中的基因表达(Bachan和Dinesh-Kumar,2012; Huang等,2012; Zhou等,2012)。但是,黄瓜中尚未报道基于病毒的miRNA沉默(VBMS)。在这项研究中,开发了一种基于TRV的VBMS系统,该系统可以在一段时间内有效抑制黄瓜中的内源性miRNA的活性,并且可以为进一步分析黄瓜对C. cassiicola的抗性机理提供策略。
材料和方法
植物材料
将本氏烟草(N.benhamiana)(本氏烟草)在25℃的温室中以16:8的光/暗周期种植20天,以进行农业浸润。 实验中使用的黄瓜品种是Xintaimici,将其在28°C的温室中以16:8的光照/黑暗周期种植10天,以进行土壤浸润。
DNA和RNA提取与cDNA合成
黄瓜叶的DNA使用植物基因组DNA试剂盒(天健,北京,中国)提取。 使用RNAprep纯植物试剂盒(天健,中国北京)提取总RNA,并使用QuantScript RT试剂盒(天健,中国北京)合成cDNA。 使用miRcute miRNA第一链cDNA合成试剂盒(天健,北京,中国)进行与miRNA对应的第一链cDNA合成。
候选miRNA及其靶标瞬时表达载体的构建
基于miR164d,miR396b,Novell-miR1和Novel-miR7(补充表S1)的前体序列,根据融合原则设计了引物。同样,基于NAC,APE,PAL和4CL开放阅读框序列(补充表S1),引物还根据融合原则进行了设计。引物由GENEWIZ(中国苏州)合成,并列在补充表S2中。通过BLAST对黄瓜基因组数据库注解目标基因1。 mRNA原始数据以登录号SRP117262存入NCBI序列读取档案(SRA);小RNA原始数据以登录号SRP117230存放在NCBI序列读取档案(SRA)中。
pRI-101 AN(TaKaRa,中国大连)是用于植物转化的二元载体,可以有效表达外源基因。构建植物表达载体pRI-101 AN和pRI-101 AN-GUS以验证miRNA与靶标之间的相互作用。为了将cDNA克隆到载体中,使用了InFusion HD克隆试剂盒(Clontech,CA,美国)。通过测序确认所有构建的载体,然后转化入根癌土壤杆菌(A.tumefaciens)菌株EHA105。
本塞姆氏烟草中候选miRNA和靶标的共转化
为了验证候选miRNA与靶基因之间的相互作用,我们通过根癌农杆菌转化在本氏烟草叶中瞬时表达了构建的载体。 用悬浮缓冲液(10 mM MES,10 mM MgCl2和200μM乙酰丁香酮)将携带农杆菌的构建体稀释至OD600 = 0.5。 将pRI-101 AN-miRNA和pRI-101 AN-GUS靶基因等体积混合以测试tae-miR408的切割功能。 正常烟草(对照)和注射了pRI-101 AN-GUS的烟草用作对照。 渗透48小时后,按照Bradford(1976)和Jefferson等的描述进行GUS染色和荧光定量分析。 (1987)。 所有实验均进行了三个生物学重复。
TRV诱导的沉默载体的构建
本研究中使用的STTM-miR164d,STTM-miR396b,STTM-Novel-miR1和STTM-Novel-miR7的序列由GENEWIZ(中国苏州)合成。 STTM引物是根据融合原则设计的,并在补充表S2中列出。 pTRV载体可以在植物中有效表达。 为了将STTM克隆到载体中,使用了InFusion HD克隆试剂盒(Clontech,CA,美国)。 通过测序确认所有构建的载体,然后转化为根癌农杆菌EHA105。
实时定量RT-PCR分析
使用SuperReal PreMix Plus试剂盒(SYBR Green)(天健,北京,中国)进行基因的qRT-PCR分析,并将黄瓜肌动蛋白基因用作内部对照。 使用miRcute miRNA qRT-PCR检测试剂盒(SYBR Green)(天健,北京,中国)对miRNA进行qRT-PCR分析,并使用U6 snRNA作为标准化数据的参考。 所有qRT-PCR分析均在LightCycler 480系统(美国罗氏,加利福尼亚州)上进行,所用引物列在补充表S2中。 相对表达通过2-ΔΔCt方法计算(Livak和Schmittgen,2001),标准差通过三个生物学重复计算。
黄瓜子叶中木质素的测定
木质素含量的测定按照Morrison(1972)的描述进行了一些修改。木质素含量定义为每克鲜重在280 nm处的吸光度。将1 g黄瓜子叶样品用95%乙醇匀浆,并以5000 rpm离心5分钟,然后用95%乙醇将沉淀物洗涤3次。将样品用乙醇和正己烷(1:2,v / v)的混合物洗涤两次后,通过离心收集沉淀物。将干燥的样品溶解在2 mL溴乙酰基和冰醋酸(1:3,v / v)溶液中。在70°C下进行30分钟的水浴30分钟后,添加0.9 mL 2 mM NaOH以终止反应。然后,向样品中加入2 mL冰醋酸和0.1 mL 7.5 M盐酸羟胺,并用冰乙酸将样品稀释至5 mL。在5000 rpm离心5分钟后,收集上清液以确定280 nm的吸光度。
统计分析
所有数据均为三个生物学重复的平均值(±SD)。 使用IBM SPSS Statistics 22软件通过单向方差分析(ANOVA)进行统计分析,显着性差异由Duncan的多范围检验确定(P <0.05),并以字母符号表示。
Results
结果
候选miRNA与靶基因之间相互作用的验证
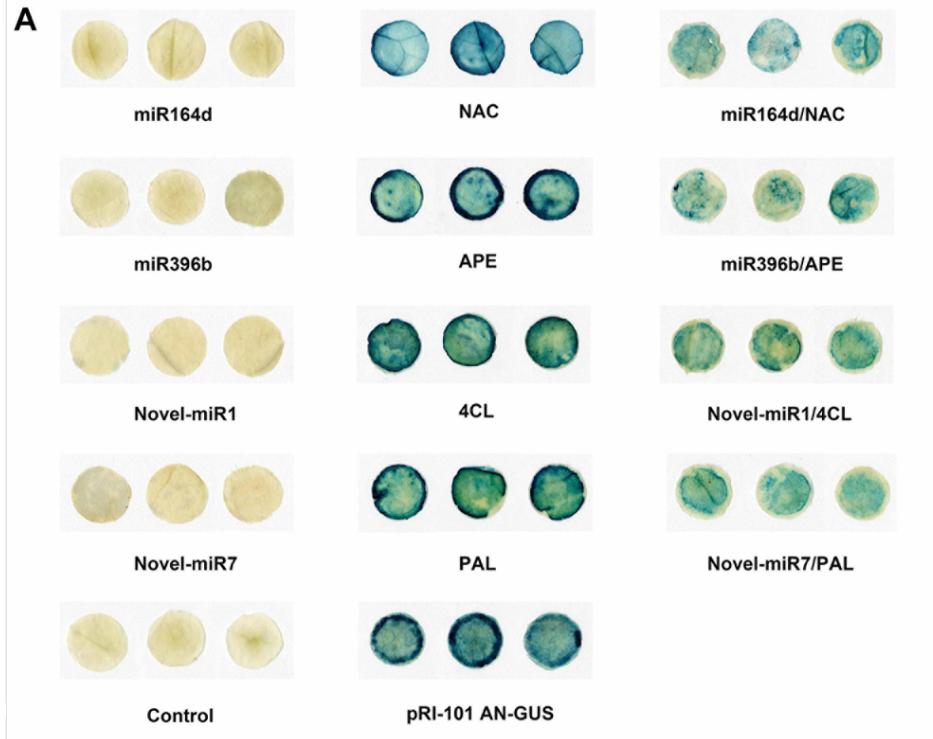
我们之前的研究发现,次级代谢在黄瓜中对卡西氏梭菌感染有重要作用(Wang等人,2018)。 根据先前的研究,选择了两个已知的miRNA和两个具有目标的新型miRNA,因为它们可能与黄瓜中C. cassiicola的抗性增强有关(表1)。 在植物中,miRNA主要通过识别靶基因mRNA上的特定位点并与之结合形成沉默复合体来调节其靶基因,从而抑制靶基因mRNA的翻译。 候选miRNA和靶基因结合位点如图1所示。
为了验证相互作用,我们将候选miRNA和靶基因共转化为烟叶。我们使用含有GUS基因的载体pRI-101 AN-GUS,通过GUS组织化学染色和荧光定量测试了miRNA对靶基因的抑制作用。正常烟草(对照)和接种pRI-101 AN-GUS的烟草用作对照。 GUS组织化学染色的表型如图2A所示。
为了验证相互作用,我们将候选miRNA和靶基因共转化为烟叶。我们使用含有GUS基因的载体pRI-101 AN-GUS,通过GUS组织化学染色和荧光定量测试了miRNA对靶基因的抑制作用。正常烟草(对照)和接种pRI-101 AN-GUS的烟草用作对照。 GUS组织化学染色的表型如图2A所示。在用重组载体pRI-101 AN-miRNA(miR164d,miR396b,Nove-miR1和Novel-miR7)和正常烟草(对照)接种的烟叶中未观察到GUS表型。在接种pRI-101 AN-GUS的烟叶中观察到GUS表型,而接种pRI-101 AN-GUS靶基因(NAC,APE,4CL和PAL)的烟叶中观察到GUS表型,其中靶基因融合在GUS基因表现出相似的表型。
然而,在带有pRI-101 AN-miRNA(miR164d,miR396b,Novel-miR1和Novel-miR7)和pRI-101 AN-GUS靶基因(NAC,APE,4CL和PAL)。共转化的叶片中,GUS表型显着降低
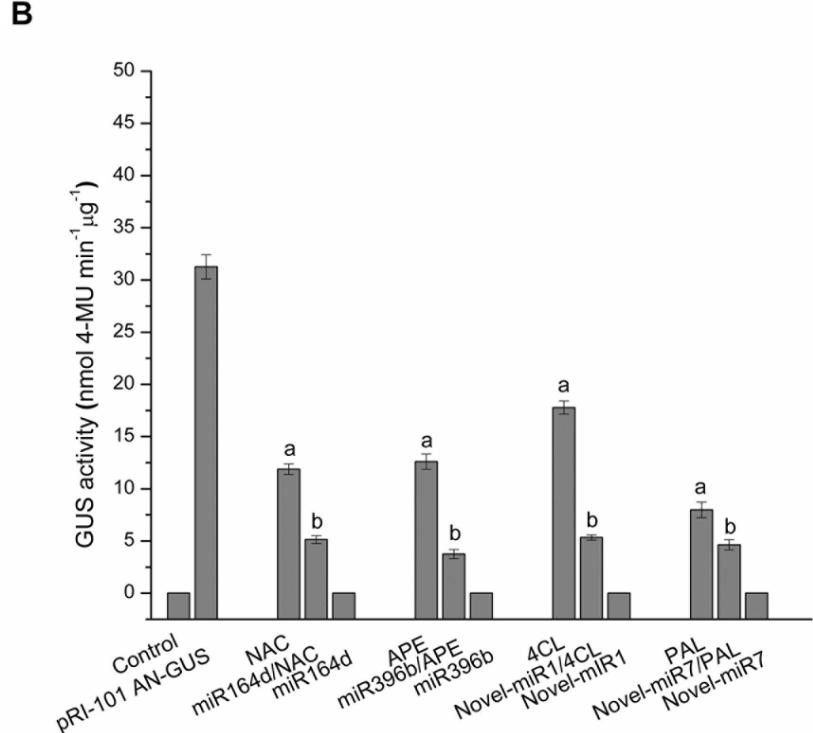
通过荧光定量测定法测量接种了不同重组载体的叶片中的GUS蛋白活性(图2B)。 在普通烟草和接种了pRI-101 AN-miRNA(miR164d,miR396b,Novel-miR1和Novel-miR7)的叶片中未检测到GUS荧光。 接种pRI-101 AN-GUS和pRI-101 AN-GUS靶基因(NAC,APE,4CL和PAL)的叶片中GUS荧光值增加。 pRI-101 AN-miRNA(miR164d,miR396b,Nove-miR1和Novel-miR7)和pRI-101 AN-GUS靶基因(NAC,APE,4CL和PAL)共转化的烟叶GUS荧光值 )确定。 GUS荧光定量分析支持GUS组织化学染色的结果。 这些实验表明候选miRNA与靶基因之间存在负调控关系。
候选miRNA和靶基因的瞬时表达水平
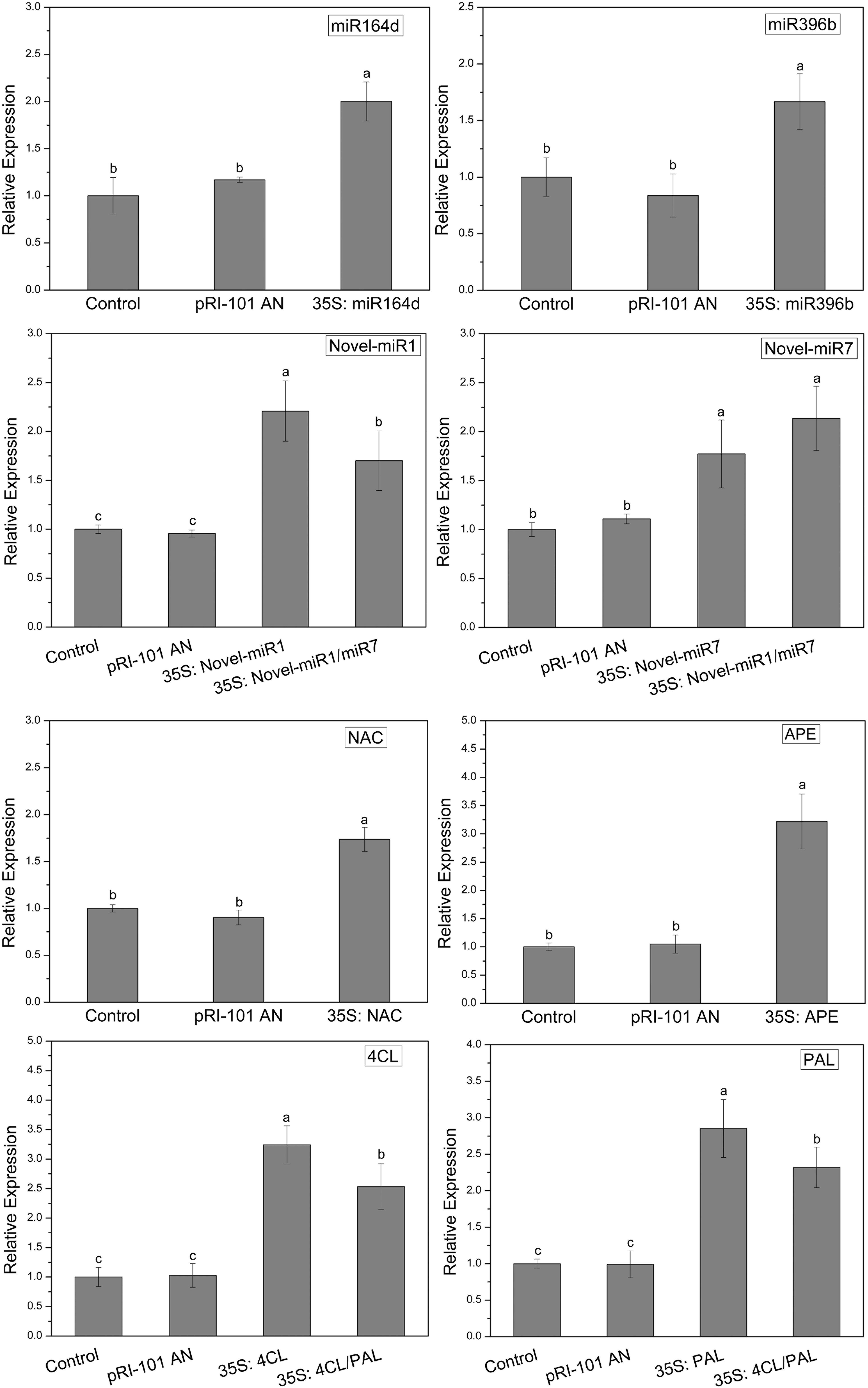
在这个实验中,miR164d,miR396b,Novell-miR1,Novell-miR7,Novell-miR1 / Novel-miR7(1:1,v / v),NAC,APE,4CL,PAL和4CL / PAL(1:1, v / v)通过农杆菌浸润瞬时表达于黄瓜子叶中。 正常烟草(对照)和注射了pRI-101 AN的烟草用作对照。 通过qRT-PCR检测转基因黄瓜中候选miRNA和靶基因的表达水平。 结果如图3所示。在正常烟草和pRI-101 AN实验组中,基因表达水平相似。 过表达组的基因表达水平明显高于对照组,这证明瞬时转化是成功的,可用于进一步的实验。
候选miRNA和靶基因在黄瓜和C. cassiicola相互作用中的功能
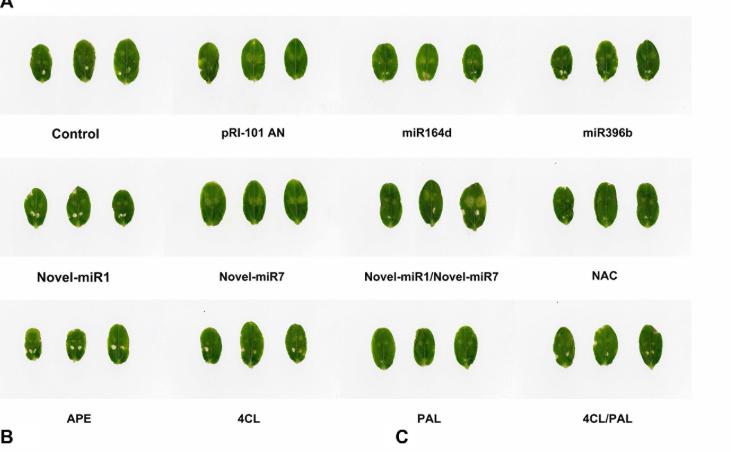
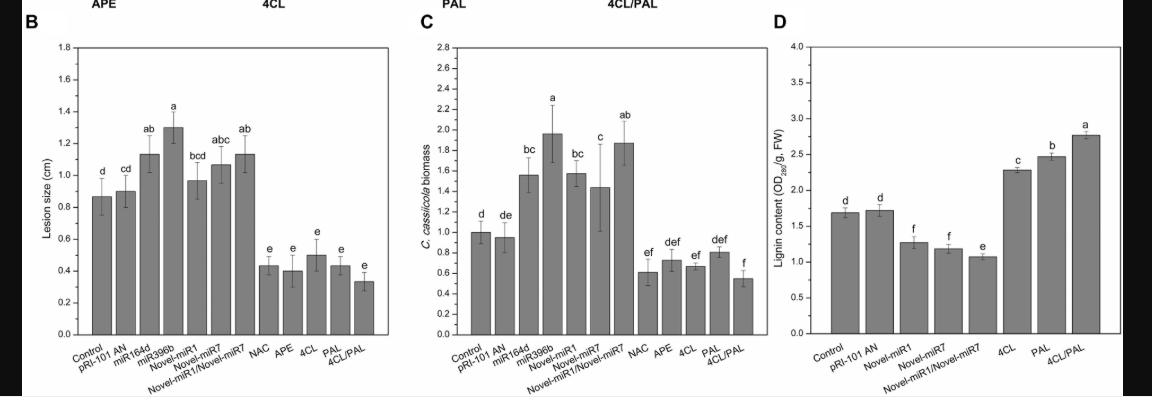
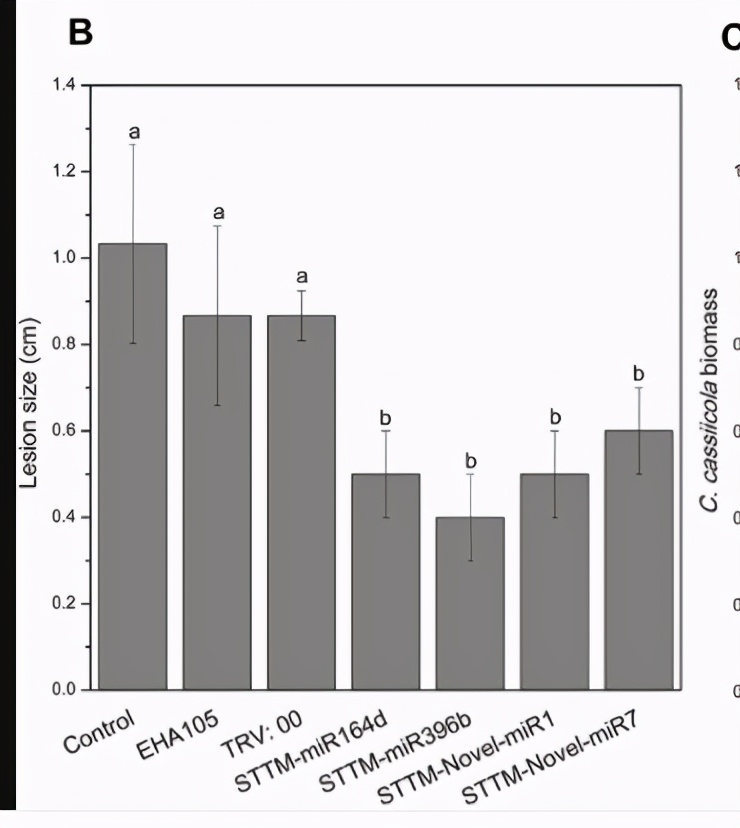
我们进行了黄瓜子叶中瞬时表达的分析,以探索候选miRNA和靶基因在对C. cassiicola的抗病性中的功能。普通黄瓜子叶(对照)和注射了pRI-101 AN的黄瓜子叶用作对照。在进行瞬时表达的农用浸润后两天,通过将卡西氏梭菌的孢子悬浮液滴到黄瓜子叶上来收集农用浸润的子叶用于疾病分析。接种后第5天的疾病表型表明,实验组miR164d,miR396b,Noveal-miR7和Novel-miR1 / Novel-miR7在C. cassiicola诱导的病变中明显大于对照组(图4A, B),表明这些miRNA在黄瓜子叶中的瞬时表达降低了对C. cassiicola的抗性。
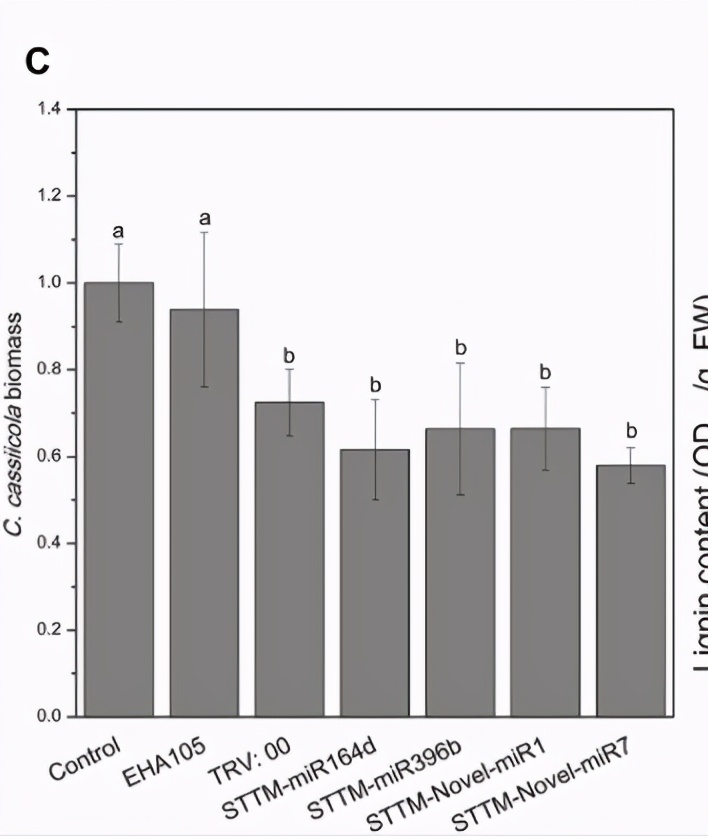
然而,在NAC-,APE-,4CL-和4CL / PAL浸润的叶片上,由卡西氏梭菌诱导的病变明显小于对照(图4A,B),表明这些基因在黄瓜中的瞬时表达子叶提高了对C. cassiicola的抗性。 C. cassiicola Actin基因的表达被用作真菌生长的标准。在miR164d-,miR396b-,Noveal-miR1-和Novel-miR7浸润的叶片中,C。cassiicola的生长显着高于对照,而NAC-,APE-,4CL-和NAC-中的生长。 4CL / PAL浸润的叶子明显低于对照的叶子(图4C)。此外,Noveal-miR1组的病灶没有明显增加,但C. cassiicola的生长却显着增加(图4A–C)。瞬时表达分析表明,候选miRNA的过表达可以降低对C. cassiicola的抗性,而对应于候选miRNA的靶基因的过表达可以提高对C. cassiicola的抗性。这些结果与我们先前的分析一致。
先前的分析表明,Novel-miR1和Novel-miR7可以分别抑制4CL和PAL。 4CL和PAL基因是木质素合成途径中的两个关键基因,木质素含量与抗病性呈正相关。在此实验中,Novell-miR1,Novell-miR7,Novell-miR1 / Novel-miR7(1:1,v / v),4CL,PAL和4CL / PAL(1:1,v / v)瞬时表达于黄瓜子叶通过农杆菌渗入。正常烟草(对照)和注射了pRI-101 AN的烟草用作对照。在进行瞬时表达的农用浸润后两天,准备了农用浸润的子叶以测定木质素含量(图4D)。确定木质素含量以进一步分析候选miRNA和靶基因的过表达对黄瓜子叶木质素积累的影响。如图4D所示,与对照相比,在4CL-,PAL-和4CL / PAL浸润的样品中,木质素含量显着增加,在Novel-miR1,Novel-miR7-和Novel与对照相比,-miR1 / Novel-miR7浸润的叶子明显减少。 4CL / PAL浸润叶片的木质素含量最高,而Novel-miR1 / Novel-miR7浸润叶片的木质素含量最低。结果表明,过表达4CL和PAL可以增加黄瓜叶片中木质素的含量,而过表达Noveal-miR1和Novel-miR7可以降低黄瓜叶片中的木质素。
TRV诱导的VBMS
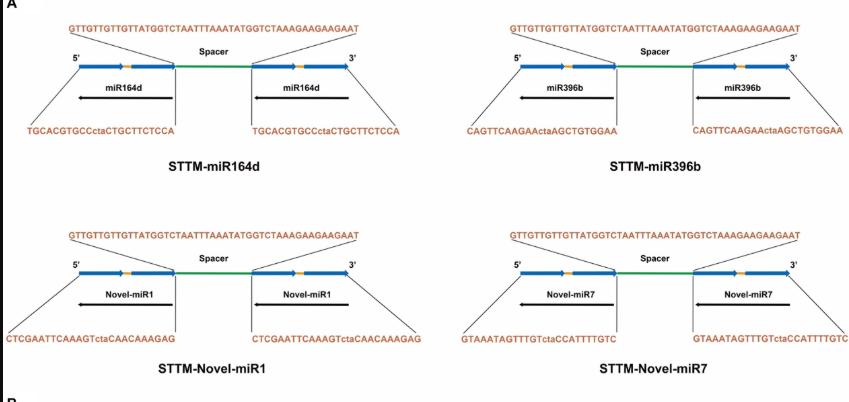
在这项研究中,基于TRV构建了STTM-miR164d,STTM-miR396b,STTM-Novel-miR1和STTM-Novel-miR7重组载体。 STTM结构如图5A所示。
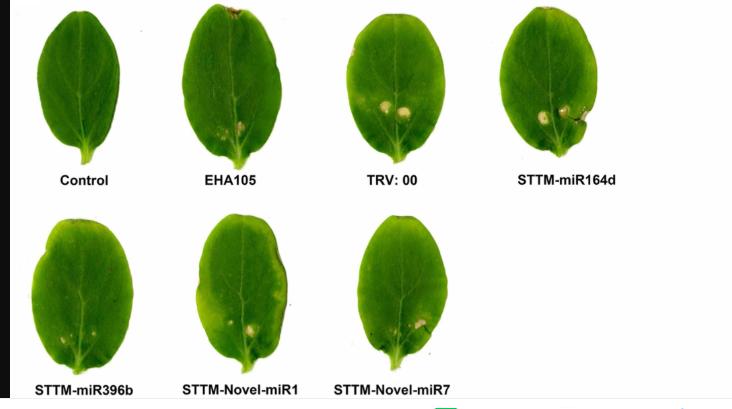
本研究中使用的STTM-miR164d,STTM-miR396b,STTM-Novel-miR1和STTM-Novel-miR7的序列列在补充表S1中。结构的侧面是TM,两端的限制性酶切位点是EcoRI和SacI。通过In-Fusion技术,将STTM和pTRV2用于构建重组载体。将重组病毒TRV:00(pTRV1 + pTRV2),TRV:STTM-miR164d,TRV:STTM-miR396b,TRV:STTM-Novel-miR1和TRV:STTM-Novel-miR7浸入黄瓜子叶中。接种7天后,接种TRV重组病毒的黄瓜子叶中出现萎黄病和一些病毒斑,但对照和根癌农杆菌EHA105的子叶上未观察到明显的表型(图5B),表明TRV已成功在黄瓜的子叶中复制和繁殖。
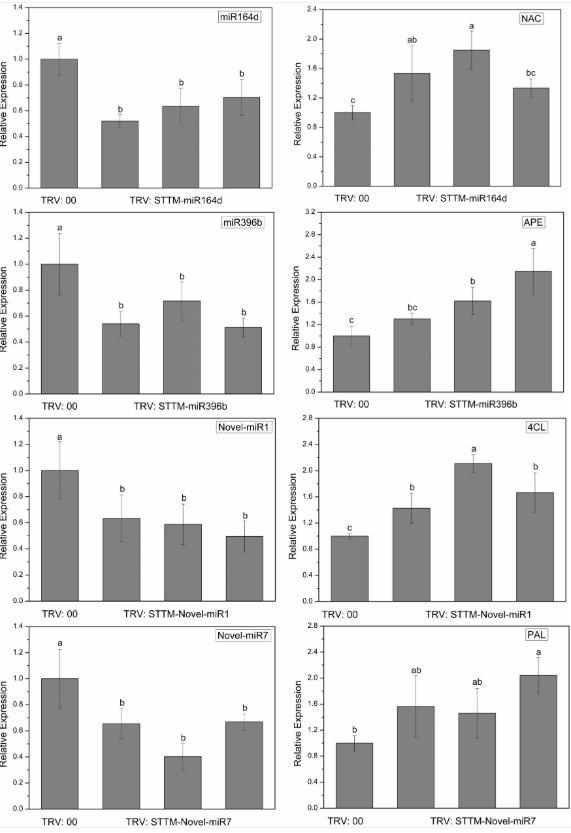
为了探索候选miRNA的沉默效果,我们通过qRT-PCR检测了注射TRV:STTM的黄瓜子叶中候选miRNA和相应靶基因的表达水平。 如图6所示,TRV:STTM-miR164d,TRV:STTM-miR396b,TRV:STTM-Novel-miR1和TRV:STTM-Novel-miR7浸润的子叶中候选miRNA的表达水平显着降低,并且 对应于这些miRNA的靶基因的表达水平上调。 这些结果表明黄瓜子叶中的候选miRNA被成功抑制。
候选miRNA沉默后黄瓜子叶对C. cassiicola的应答
为了确定STTM-miRNA在黄瓜和C.cassiicola之间的相互作用中的作用,我们接种了TRV:00(pTRV1 + pTRV2)-,TRV:STTM-miR164d-,TRV:STTM-miR396b-,TRV:STTM-Novel -miR1-和TRV:STTM-Novel-miR7-浸润的黄瓜子叶与C. cassiicola一起观察表型的变化。接种C. cassiicola的5天后,渗透子叶的TRV:00(pTRV1 + pTRV2)的病害与对照子叶之间无显着差异。但是,C。cassicola诱导的miR164d,miR396b,Noveal-miR1和Novel-miR7沉默的黄瓜子叶的损伤明显小于对照(图7A,B)。
通过qRT-PCR检测了被感染黄瓜子叶中的C. cassiicola生物量(图7C),
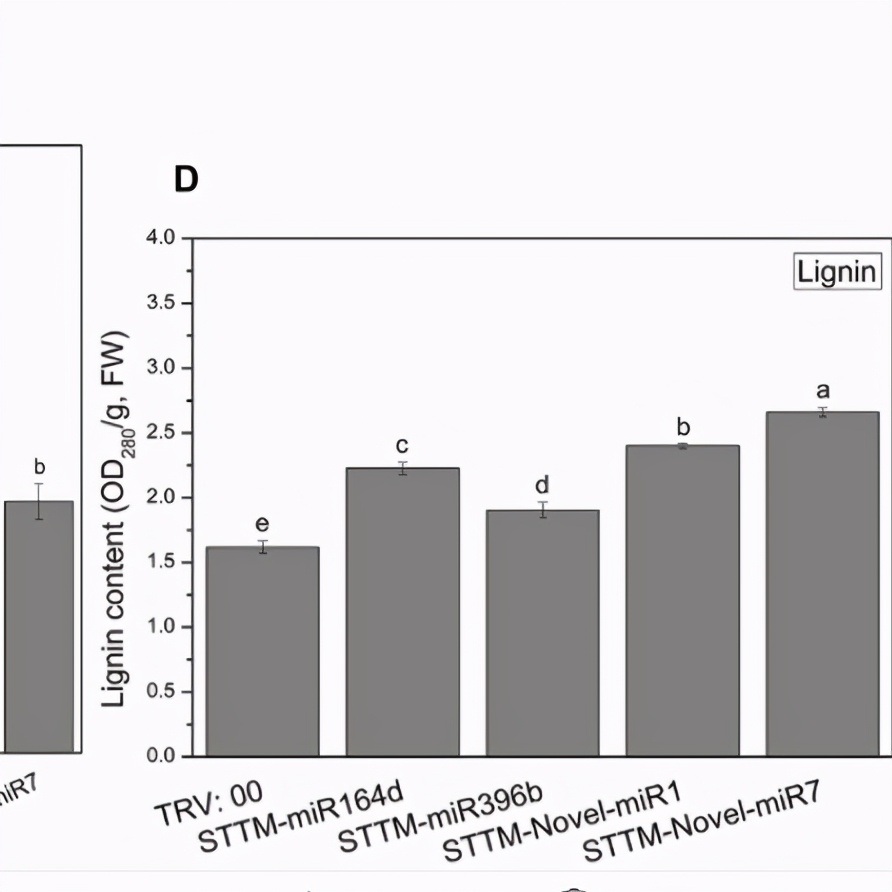
候选miRNA沉默的黄瓜子叶中C. cassiicola Actin基因的表达显着降低。因此,使miR164d,miR396b,Noveal-miR1和Novel-miR7沉默会增加黄瓜对C. cassiicola的抗性。确定木质素含量以进一步分析沉默候选miRNA对黄瓜子叶木质素积累的影响(图7D)。
在所有沉默的植物中,尤其是在Novel-miR1和Novel-miR7沉默的植物中,木质素含量均显着上调。由于4CL(被Novel-miR1抑制)和PAL(被Novel-miR7抑制)是苯丙烷途径中与木质素合成有关的上游和下游基因,因此这一发现也与我们之前的实验结果一致。
讨论
由于miRNA没有编码功能,因此它们只能通过抑制或降解相应的靶标来发挥作用。与非生物和生物胁迫相关的基因已被证明是miRNA的靶标,可用于确定miRNA的功能(Jagadeeswaran等,2009; Katiyar-Agarwal和Jin,2010)。在植物中,通过5RNA连接酶介导的cDNA末端快速扩增(5RLM-RACE)验证了miRNA与靶基因之间的相互作用(Llave et al。,2002)。 RACE方法麻烦,并且无法观察到miRNA与靶基因之间的相互作用。农杆菌介导的烟草瞬时表达高效且表达时间长,适合研究植物中的基因相互作用(Prabu and Prasad,2012; Yin et al。,2017)。该方法主要用于通过检测烟草中的GUS基因在瞬时表达miRNA和靶基因后的表达来验证miRNA与靶基因之间的相互作用(Feng等人,2013; Han等人,2016)。
NAC是一种植物特异性转录因子,参与植物的发育和植物的胁迫反应。 先前的研究表明,NAC基因家族的许多成员在病原体感染植物后表现出差异表达特性,这表明NAC基因具有对植物抗病性的响应的特定生物学功能(Jensen和Skriver,2014; Qin等, 2014)。 在最近的一项研究中,研究人员分析了与非生物胁迫响应相关的黄瓜NAC基因(Zhang等人,2017)。 但是,关于NAC基因在黄瓜和病原体之间相互作用中的作用的研究很少。 现有数据的BLAST分析显示,我们鉴定出的NAC基因为csNAC30。 一些研究表明,NAC影响次生代谢产物的合成,但具体机制尚不清楚(Zhao等,2010; Xu等,2015)。
色氨酸不仅促进内源性茉莉酸(JA)的生物合成并触发植物信号转导途径,而且参与萜类吲哚生物碱(TIA)途径,进而调节植物对逆境的反应(Sun等,2016)。 邻氨基苯甲酸磷酸核糖基转移酶(APE)是色氨酸合成途径中的重要酶,其间接参与植物次生代谢产物的合成(Dharmawardhana等,2013)
苯丙氨酸氨裂合酶(PAL)和4-香豆酸酯:CoA连接酶(4CL)是苯丙烷合成途径中的两个关键基因,与植物对外界胁迫的抵抗力密切相关。 首先,PAL将苯丙氨酸催化为肉桂酸。 然后,肉桂酸参与泛醌的合成,并被4CL催化形成肉桂酰辅酶A。 最后,肉桂酰辅酶A进一步合成了木质素和类黄酮(Kim和Hwang,2014; Li等,2015)。
在分析了目标基因的功能之后,我们选择了miR164d,miR396b,Novel-miR1和Novel-miR7及其目标基因NAC,APE,4CL和PAL进行相互作用验证。 GUS基因的组织化学染色和定量检测表明,相应的miRNA可以抑制这些靶基因,但抑制效率不是100%。 此结果可能有两个原因。 首先,靶基因的转录和核苷酸切割之间存在平衡,并且这种平衡受miRNA表达水平的影响(Nikovics等,2006)。 其次,可能是只有一部分靶标mRNA被miRNA切割和降解,而其余的靶标mRNA从切割系统脱离并正常转录(Adam等,2010)。
为了探索miR164d,miR396b,Noveal-miR1和Novel-miR7及其靶基因NAC,APE,4CL和PAL在黄瓜对C. cassiicola的应答中的功能,我们在黄瓜子叶中瞬时表达了候选miRNA和靶基因。接种卡西氏梭菌后,观察到表型变化。由于4CL和PAL是苯丙烷代谢途径中的上游和下游基因,因此我们共表达4CL和PAL来建立实验组。类似地,Novel-miR1和Novel-miR7也共表达。图4显示,靶基因过表达组的抗病性显着高于对照组,表明这些基因在黄瓜对卡西氏梭菌的抗性中起重要作用。候选miRNA过表达组的抗病性低于对照组,这可能是因为这些miRNA抑制了其靶基因的表达。通过测量感染后黄瓜子叶中C. cassiicola的生物量也证实了这些结果。数据显示,共表达的4CL和PAL组具有最高的抗病性,而相应的Novell-miR1和Novel-miR7共表达组的抗病性最低。由于苯丙烷类代谢途径影响木质素的合成,而4CL和PAL是该途径中的重要基因,因此在黄瓜子叶中候选miRNA和基因瞬时表达2天后,我们进行了木质素含量测定。图4D显示4CL / PAL浸润的叶片中木质素含量最高; Novel-miR1 /,Novel-miR7-和Novel-miR1 / Novel-miR7浸润的叶片中的木质素含量低于正常烟草,Novel-miR1 / Novel-中的木质素含量降低更为严重miR7浸润的叶子。 STTM是研究动植物miRNA功能的有效工具。唐等。 (2012年)开发了基于STTM技术的TM。 STTM的过表达已用于鉴定多种植物,例如拟南芥和小麦中的miRNA功能(Jia等,2015; Jiao等,2015),但尚未在黄瓜中报道。为了进一步探索候选miRNA的功能,我们开发了TRV诱导的VBMS使黄瓜内源性miRNA沉默。结果表明,沉默miR164d,miR396b,Noveal-miR1和Novel-miR7可提高黄瓜子叶对C. cassiicola的抗性,表明这些miRNA在黄瓜对C. cassiicola的抗性中起负调控作用。值得注意的是,Novel-miR1和Novel-miR7沉默的黄瓜子叶中木质素含量最高。这些发现还表明Novel-miR1和Novel-miR7及其靶基因之间的相互作用会影响木质素的合成,进而影响黄瓜对C. cassiicola的抗性(图8)。
结论
在我们的研究中,通过In-Fusion技术构建了表达载体,并通过农杆菌介导的烟草瞬时表达系统验证了miR164d,miR396b,Novell-miR1和Novel-miR7及其靶标的负相关性。 同时,我们发现NAC,APE,4CL和PAL的过表达可以提高对C. cassiicola的抗性,而miR164d,miR396b,Noveal-miR1和Novel-miR7的过表达可以降低黄瓜的抗病性。 我们证实,沉默候选miRNA可以提高黄瓜的抗病性,并且Novel-miR1和Novel-miR7沉默的黄瓜子叶中木质素含量显着增加。 这些候选miRNA和靶标与黄瓜木质素合成密切相关,数据与先前的分析相结合证明了次级代谢,特别是木质素代谢途径在黄瓜对C的抗性过程中的重要作用。
版权声明:CosMeDna所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流。若您的权利被侵害,请联系删除!
本文链接://www.cosmedna.com/article/836625527.html